こんばんは。10連休もいよいよ終盤ですね。

さて、そんな連休中の私ですが、とうとうオンラインでオーシャンジャックポット×4が出て、悲願の
三神獣の極宝の称号をゲットしました!
し・・・死闘だった・・・
4倍オーシャンって初プレイであっさり出たけど、eアミューズメントパス使ってからは、めっきりご無沙汰だったからな。でも、なんかゲーセン側の戦略的に大型連休の時はいつもよりも設定を甘くしているような気がしたな。一日でジャックポット×3+レジェンドモード出た日もあったし。それが功を奏したようだ。
普段はこんな感じで
本当に青だけ突出して出ねえから、このゲーセン。
ほいで、ここまでテレビゲームにハマったのって、思いかえせば
デザーテッドアイランド以来で、マジで攻略ファンサイト作りたい欲求が抑えきれないんだけど、HTMLで作成するのも今更面倒なので、とりあえずこのブログで、フォーチュントリニティ3の称号についてまとめることにしました。
のちのちは確変で行ける
背景コレクションもまとめる予定です。これはネット広しといえどもまとめている人がいないし、普通に地理の勉強になるしな。
フォーチュントリニティ3の称号一覧
どうやってもコンプリートできなさそうなのがスゴい。一生遊べるね!
※かっこの中の数字は称号獲得時にもらえるポイント数です。
1:FT3へようこそ!(0)
フォーチュントリニティ3にeアミューズメントパスを読み込ませれば誰でも取れる最初の称号。ポイントは入らないが、けっこう初心を忘れるべからずをモットーとしている
トリニター(FTジャンキーをこう呼ぶことにした)が多いのか、この称号を掲げている人はわりといる。
ちなみに、
eアミューズメントパスの認証はスロットストックがない時にしかできない。ステーションを変更する時とかに結構重要だから気をつけてくれ。
もっといえば、偶数のステーションのカードリーダーの位置は、オートエントリーユニットの野郎のせいで、なんと
払い出しエリアの中にあり、ジャックポットやレジェンドモードでたくさんのメダルが勢いよく噴射されると、カードを蹴散らし認証を切ってしまうことがある。すぐに位置を直せばリカバリーできることもあるが、完全に認証が切れるとジ・エンド。ふんじゃねーよっていう。
2:OCEAN CHANCE(5)


オーシャンジャックポットチャンスをやれば5点もらえる。しかし
ステーションチャレンジが本当に3はドSなのでダメな日は本当にチャンスすら与えられません。
チャンス時はモニターの両サイドに滝が流れる。

※訴えてもバチは当たらないであろう状況。
3:GROUND CHANCE(5)


オーシャンジャックポットチャンスよりは獲得しやすいイメージ。
チャンス時はモニターの両サイドに火が灯る。
ちなみに、
抽選開始時に色々言いすぎだと思う(「スタート」「レッツプレイボーナスメダルズ」「最初の2球はアウトポケットが無効になります」をなぜか同時にアナウンスする)。
4:WORLD CHANCE(5)


やっぱりオーシャンジャックポットチャンスよりは獲得しやすいイメージ。
チャンス時はモニターの両サイドに竜巻が発生する。
5:海龍(10)


×1のオーシャンジャックポットが当選するとゲットできる。
確率は(1/3)×(1/12)で36分の1。
余談だけど、オーシャンジャックポットは倍率抽選の結果ごとにBGMが異なり、×1はけっこう切ないストリングスメインの曲調。でも打ち込み音源の限界なのか、弦楽器というよりは
シンセサイザーっぽい。
ちなみに、私はなにげに×1のオーシャンって一度しかとったことがなかったりする。
6:海王(15)


×2のオーシャンジャックポットが当選するとゲットできる。
配当抽選のテーマ曲は緊迫感を与えるサイバーっぽい曲。ちなみに
ドとシの2音を繰り返しているだけだったりする。
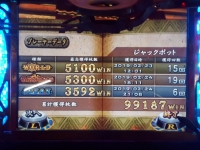
私が獲得しているオーシャンジャックポットは9割がこれ。
7:海龍神(20)

×4のオーシャンジャックポットが当選するとゲットできる。
言うまでもなく、全ジャックポットで
唯一5ケタのメダル枚数に届く可能性があるのがこのジャックポットであるため、他のジャックポットに比べて圧倒的に出ない。
ちなみに、オーシャンジャックポットのプール枚数は
メダルを1枚投入する事にカウントが0.01上がる。つまり×4のオーシャンジャックポットで10000枚獲得を狙うには、プール枚数を2500以上にする必要があるため、初期値の1000に1500を追加しなければならない。
しかし150000枚ものメダルが飲まれる前に、大抵はプール枚数が1200を超えたあたりから誰かしらがジャックポットをとってプール枚数はリセットされてしまう。というか、じゃないと鬼畜設定すぎるだろっていう。
「グレィト!スーパーチャンス!スタート!!」で始まる配当抽選時のテーマ曲は
まさかのコーラス付き。ディープブルーの映像が合いそうな雄大なテーマ曲で作曲者がイメージした海は
絶対に暖流じゃなくて寒流。
8:大地神(20)



グラウンドジャックポットが当選するとゲットできる。
つまりジャックポットステップのポケットに3回以上入ると獲得。でもまあOUTポケットがジャックポットポケットの隣にあるため、だいたいは「ワ~オジャックポットリーチ」のアナウンスのあとに抽選終了することが多い。
ちなみに、ジャックポットすると「ココングラッチュレイション!」と、
ちょっとドモる。
個人的にはこのグラウンドジャックポットの払い出しのテーマ曲が
一番野蛮で好き。映像も好き。
前奏でウシの足がドシーンってアップで映るところとかすげえ好き。
払い出しのテーマ曲は
払い出し残り枚数が1000枚を切るとB面的な曲に移るのだが、グラウンドジャックポットは2000枚以下が多いため、けっこうな確率でB面が聴けます。
最後、ウシが火山の噴火の勢いで空に発射されるのは結構シュール(どこへ行くのだろう)。あと、前作で登場した黄金色のフェニックスも友情出演してます。
9:太陽神(30)



ワールドジャックポットが当選するとゲットできる。当初はしけたすごろくだな、とか悪態を付いていたが、結果的にこのジャックポットチャンスが最も面白い。まあ、最も私がよく当たるからなんだけど。
あと抽選時の曲がめちゃくちゃいい。特にジャックポットの期待度が高い内周のテーマ。
とはいえ、外周でも黄色のクルーンに入れば、
結構な確率でジャックポットワープできたりする。桃鉄の目的地カードみたいだよな、これ。
 10:三神獣の秘宝(100)
10:三神獣の秘宝(100)

オーシャン、グラウンド、ワールドのすべてのジャックポットを獲得すると与えられる称号。このゲームのサブタイトルでもあるので、私はこの称号をセットしています。
ラーメン屋とかでも屋号のメニューをとりあえず注文したくなるじゃないですか。
11:海龍神の一撃(30)

オーシャンジャックポットの獲得枚数が4500枚を超えるとゲットできる。×4のオーシャンジャックポットなら1250枚程度のプール枚数で達成できるのだが、まあ当たらない。
ちなみに、4500枚を超えると
トリニティジャックポットというジャックポットの名称(アナウンスではスペシャルジャックポット)になり、スタッフロール付きの特別ムービーが流れます。

ちょっとネタバレしちゃっている気がする。すまん。あと
ハニタローだけはマジで忘れられている気がして本当に気の毒。
12:大地神の連撃(30)

グラウンドジャックポットの獲得枚数が4500枚以上。ジャックポットステップポケットに6回~7回入れないといけないため、なにげに結構辛い。
グラウンドジャックポットって大抵はステップポケット3~4回でゲームセットしちゃうことが多いから、称号獲得はマジで奇跡。
13:太陽神の進撃(50)

ワールドジャックポットの獲得枚数が4500枚以上。
ワールドジャックポットの初期値は2000枚なので、
2500枚分のプレーヤーたちの犠牲が必要になってくる。大抵は3000枚前後でジャックポットが起きてしまいリセットされる。
ちなみに、ワールドジャックポットは店が設定をいじくらない限り
5000枚以上はプールできない。結局、その設定を変えている店舗が全国ランキングで猛威を振るうのでちょっとフェアじゃない気がします。
14:三神獣の極宝(300)

オーシャン、グラウンド、ワールドのすべてで4500枚以上のジャックポットを獲得する。
私もとうとうオーシャンを撃破して手に入れました。うれぴい。
でも別にセットはしていない。やはり屋号が好き。
15:限界突破(10)
グラウンドジャックポットの抽選で「限界突破ボーナス!(※声が可愛い)」を出す(ただし初回のみ)。つまりステップポケットに4回以上ボールを入れる。
グラウンドジャックポットってある程度
盤面の回転速度が速くないと出ない印象がある。低速で出た試しなし。そのためなのか、ゲーセンによっては抽選の最中に回転速度を変えたりしてくるし(※)。
あと、抽選の初期に「10」が続くと役物の回転のタイミング的に期待度が高いような・・・あくまでも個人の見解です。
※その後、低速について多少考え方が変わる出来事が起きました。
16:ファーストアウト(5)

グラウンドジャックポットの抽選が最短の3球で終了するともらえる慰めの称号。
ゲーム終了の音楽がオーシャンジャックポットの×4に入った時と同じなのはどうにかならないかね(ならない)。
17:GROUND MAX9999(100)
グラウンドジャックポットの抽選でステップポケットに11~12回ボールを入れる。現実にありえるのだろうか。
ステップポケットは20ポケット中3箇所だが、回転の速度やタイミングによって、この20ポケットに入る確率は
同様に確からしくない気がする。

称号獲得目前で、
ウシに寸止めをされたの図。なんと限界突破ボーナスが立て続けに8回も出た。
ラストで力尽きたのも、ジャックポットポケットに役物が入れようとしてイレギュラーバウンドで隣のアウトポケット入っちゃった感じ。ここまでいくと、逆に悔しい思いの方が優ってしまうのだが(この称号のポイントが知りたかった!)、気になったのは、
ルーレットの回転速度が低速だったということ。
つまり、即座に外れにするにせよ、逆に大当たりにするにせよ、イレギュラーバウンドが少ない低速の方がメカが操作しやすいんじゃないかという結論に達した。
18:NEXT OCEAN(10)
グラウンドジャックポットの抽選でオーシャンステップポケットに3回ボールを入れる。オーシャンポケットはたった1箇所しかないので、3回も入ったことないです。

※2ヶ月後ついに出ました。ちなみにオーシャンジャックポットチャンスの結果は惜しくも800枚でした。
19:NEXT WORLD(10)

グラウンドジャックポットの抽選でワールドステップポケットに3回ボールを入れる(ちなみに4回以上入れてもハズレ扱い)。
なぜかこちらは何回か起きたことがあります。
20:スリーアウト(20)
OUTポケットに3球連続でボールを入れるという逆にすごい称号。OUTポケットは東西南北に4箇所あるため、回転速度が一定なら入る確率は同様に確からしい気がする。
すると、(1/5)×(1/5)×(1/5)なので1/125の確率で現実に起こりえます。
ポイントについては長らく謎だったんだけど、行きつけのゲーセンの常連さん(※つよい)が快く教えてくださいました。ありがとうございます!
21:GROUND LOOP XX(5)

グラウンドジャックポットの抽選で10球以上粘ると獲得。その後は最高記録が数字で表示されます。私は26球とかだったかな、あとで確認しよう。
ちなみに、はずしにはずし続けて500枚に達すると回転が途中で止まり左回転に変わる。
でも当たらない。
22:NEXT OCEAN JP(20)
グラウンドジャックポットの抽選でゲットしたオーシャンジャックポットチャンスでジャックポット。む・・・無理だろ。
ちなみに、この時にグラウンドジャックポットを出した場合は、グラウンドジャックポットの払い出しを終えてからオーシャンジャックポットチャンスに行きます。
フォーチュントリニティ2のオールジャックポットチャンスみたいに連続抽選はしません。

長らく伝説上の存在だと思われていたが、令和に入ると目撃例が相次ぎ、2020年8月未明、
7個もオーブが出てきた3番ステーションでシェンロン的に出現させることに成功した。
 23:NEXT WORLD JP(20)
23:NEXT WORLD JP(20)
グラウンドジャックポットの抽選でゲットしたワールドジャックポットチャンスでジャックポット。む・・・無理だろ。
24:ファーストハント(10)

ワールドジャックポットを1球目で獲得。わりと起きる。図のようにジャックポット直後とかでも起きる。
25:AQUA(40)
フォーチュントリニティ1のアクアジャックポットの払い出しムービーを見るとゲットできる。ここから31の称号までは、そんな感じの懐かし映像集です。
ちなみに、こういった特別演出は、各色のジャックポット10回に1回の頻度で、
初代→BEAT→2の順番で出現する。つまり、30回のジャックポット(20日くらいかかる)でちょうど一周する。

※2020年9月、過去のジャックポット演出の中で一番最後に鑑賞できました。長かった・・・FT4になる前に見れて良かった。
26:FIRE(40)

フォーチュントリニティ1のファイアジャックポットの払い出しムービーを見るとゲットできる。かっこいい。赤のジャックポットは初代から野蛮であった。というか
スーパードンキーコングとかクラッシュバンディクーっぽいよな。
1のムービー演出で唯一視聴できたやつ。グラウンドジャックポットのムービーの代わりに出てきたから色で対応してんだろうな。
27:FORTUNE(40)

フォーチュントリニティ1のフォーチュンジャックポットの払い出しムービーを見るとゲットできる。
私、1はそんなにやったことないんだよね。確か黄色がビンゴゲームだった気がする。
ビンゴギャラクシー!!
ちなみにトロッコの映像が
酔うくらい良く出来てた。そういや
レールチェイスってガンシューティングゲームあったな。面白かったなあれ。
28:BEAT(40)

フォーチュントリニティ1のキャラのスペシャルジャックポットムービー。どの色のジャックポットでも出現するため、これはわりとよく見れる。
サニーにとって祖父母に当たる人たち(+さる)の在りし日の姿がそこにある。
29:クリスタル(40)
30:ライジング(40)
31:フォーチュン(40)
フォーチュントリニティ2の各ジャックポットの払い出しムービーを見るとゲットできる。
3ではまだ一度もお目にかかったことがない。
私はクリスタルジャックポットの曲が好きでした。昨年末の立川のゲーセンを思い出すなあ・・・「倍率抽選で最大3倍の大チャンスを!」とかの実況が好きでした。
※その後、7月にフォーチュンだけ放送してくれた。そりゃ出るだろ、30回以上すごろく上がってるんだから。

内容は
シュールすぎてコメントは差し控えさせていただきたい。

※さらに8月にライジング演出も出た。がんばれジャイアン(塔から落下しかけたときハンマーをピッケル替わりにするのがかっちょええ)。

※別ステーションのおばあさんが出していたやつ。羨ましすぎる!


※遅ればせながら2020年2月に出せました。ちょっとメルヘンかつロマンチックで萌える。フリオの青春時代というか。ちなみにキャラがジャックポットの演出に登場するのってなにげに歴代でこれだけのような気がする(3ではスタッフロールのラストで後ろ姿が一瞬のみ)。
32:KING TRINITY(500)

1~3の全ジャックポットムービーを見る。過去のシリーズのムービーはごくまれにしか放送されないから、あと5本も見れる気がしない。
特に青が。
※2年弱プレイし続けてやっと獲得。
33:陣地獲得者(3)

ワールドジャックポットの抽選でMY陣地をゲットする。これは先着ルールで、一度自分の陣地にしたマスはジャックポットでリセットされない限り変更されない。
ほかのプレーヤーが自分の陣地に止まったら、陣地に書いてある枚数の半分をカード認証後に払い出してもらえる。

ちなみに、この時の払い出しは嬉しいことに例外的に
チェッカーが利用できる。
※他の例はレベルアップチャンスとレジェンドモードだけ・・・と思われたが、フィールド払い出しの最中にホッパーのメダルが切れた時、店員さんがメダルを補充するためにリセットボタンを押すと、チェッカーのロックが外れて利用できちゃうことが判明した。
 牛歩カードの呪い
牛歩カードの呪いにかかるとふりだしから全てのマスが自分の陣地になります。
34:MYマイ陣地(5)

自分の陣地に自分が止まる。桃鉄のように増資とかはできない。
35:地主(3)

自分の陣地に他のプレーヤーが止まる。嬉しい。でも意外と誰も止まってくれない。
プレーヤーが自分の陣地に止まった回数×3ポイントがもらえるっぽい。
36:宝珠(1)

オーブが出現すると1ポイントだけもらえる。
ちなみに、フィールドに乗っけられるオーブの数は
最大15個。私は6個までしか見たことがない。




































































































































































