だいたい76才とかそのくらいまで元気でチャキチャキ生きて、孫や近所の子供たちから「おばあちゃんが世界でいちばん大好き」と言われることです。わたしゃ印税で孫にたくさんおこづかいをあげるためにかきつづけるよ。いろいろ。(『ちびまる子ちゃん13巻』116ページ)
最近、西部劇ブームからいつのまにか『ちびまる子ちゃん』にブームが移って、この前も、はまじの本とか買ってたんですが、虫の知らせだったのかなあ・・・もともとまるちゃんって好きな漫画だったんだけど、突然また見出したからね。
はまじは、さくらは観察眼がすごいって言ってたけど、本当にそれで、小学生のコミュニティをすごいリアリティで描いたのが『ちびまる子ちゃん』なのは今更私が言うまでもない。
出発点はエッセイ漫画とは言え、だんたんネタも尽きるし、そうなるとやっぱりフィクションのキャラクターや物語が増えて、リアリティって減衰していくものなんだけど、この前単行本の15巻以降(※実はりぼんの連載って14巻で突然中断していた)を買って読んだら、やっぱり心理描写がメチャメチャ上手でさ。
さくら先生って、子どもの無邪気なところだけじゃなくて、邪悪な面や残酷な面もちゃんと描くじゃん。
昨今、漫画やアニメにブサイクキャラがいなくなったって言われて久しいけど、現実にはブサイクって今なおちゃんといてさ、それを果敢に描くじゃん。しかも、コメディとして後味悪くなく描けるっていう、本当に天才というか、稀有な才能を持った人だったよね。
もともと女性ってカンも鋭いし、すごい人間観察の能力って高いと思うんだけど、女流漫画家ってやっぱり、恋愛少女漫画に行っちゃうし、失礼な言い方だけど、画力的に正統派少女漫画に達しなかったというのが、もう、すごいいい結果になったって事だよね。
話は変わって、この前15年ぶりくらいに小学校からの友達に会ったんだけど、こいつは大学で工学とかやってて、すごい自由奔放で天才肌な人なんだけど、やっぱりとんでもねえなって改めて思ってさ。
頭のいい人って、物事を考えるときフラットというか、ゼロベースというか、先入観がないんだよね。誰かの受け売りとかじゃなくてさ。
これが私レベル(=バカ)だと、こういう本があるとか、こういう学者がいるみたいなレファレンスで逃げるというか、トラの威を借る姑息な真似をするんだけど、いや、冷静に一から考えてみようって、ちゃんと自分の脳みそが使えるんだよね。正しい脳みその使い方、みたいな。
で、さくら先生もそのタイプなんだよな。ブスに失礼だからって言って、ブスを描かないのが正解なのかっていうとそれは違うじゃん。そんなのリアルな小学校の世界じゃないじゃない。
ポリティカル・コレクトネスとか今はすごい気をつけなきゃいけない時代にはなっているんだけど、そこで懸念されるのが、じゃあ、そういう社会問題について考えたり、発言するのは面倒くさいからいいやっていう結果になりかねないよってことで。
だから、今やっているアニメの『ちびまる子ちゃん』も、もともと原作にあった毒というかシニカルな要素がかなりオミットされちゃっているっていうのも、そういう配慮があるんだろうけど、本当にそれでいいのかっていうね。
んなこといっても、今はそういう時代なんだろうな。社会が不安定で、互いにみんな厳しくて、ストレスも強くて、結局みんな癒しを求めてるんだろうなって思う。
だから、毒にも薬にもならないような内容がマイルドな漫画か、逆にフラストレーションを発散させるような、物凄い残酷でグロテスクな漫画(ただしそれは皮相的なものである)の二極化みたいになっているように思うんだけど、『王様の耳はロバの耳』じゃないけど、本来漫画の面白さっていうのは風刺であって、世間ではなんだかんだ綺麗ごとや建前言ってっけど、本音はこうだろ?ガビーンみたいなオチが『ちびまる子ちゃん』の本質だと思いますね。先生が永沢君でスピンオフを描いた理由もなんとなく解るんだ。
そんな繊細な描写ができる作家さんの一人がいなくなったと思うと、やっぱり残念でなりません。
データベースシステム覚え書き②
2018-08-26 12:06:53 (7 years ago)
-
カテゴリタグ:
- 情報
過去に稀に見る高度プロフェッショナルな課題。勝手になんらかのソフトをダウンロードして、シラバスのヒントを頼りに課題のデータベースを完成させなさい、という学生の主体的思考を重んじた丸投げの課題。
ちなみにテキストも理論的なものが書いてあるだけで、特定のソフトの使い方などは書いてないので、ほぼノーヒント。テキストはあくまでテキストでマニュアルじゃないのである。(´;ω;`)
つまりコマンドプロンプトとかいじくった経験のある人じゃないと、自分のパソコンぶっ壊しそうでちょっと踏み出せない。てことで、コンピュータに強い後輩に泣きつきました。やっぱり理系はカッチョいい。
逆に、環境設定とかできれば、作成する表自体はかなりシンプルというか・・・エクセルで10分で作れるものだったりする。
結局、大企業の膨大なデータなんかは、今もDBMSで管理しているらしいんだけど、そういう場合もサーバーとかで構築しているみたくて、家庭用パソコンでデータベースを作成とかは現在はほとんどしないし、必要がないんだってよ。
問1
RDBMSをインストールした上で,データベース(名称は任意)を作成しなさい。次に,以下の2つの表を作成し,データも登録しなさい。その際,以下の(a)から(c)を提出しなさい。
名称は任意なので「KADAI01」にしました。
(a)STUDENTS(学生)表の定義のために入力したSQL文
学生番号はユニークな主キーなので、設定でPRI(プライマルキー)とする。
名前と電話番号はデフォルトでNULL(データなし)とするが、学籍番号はしない。
()のなかの数字は桁数。電話番号はハイフンを入れるため、数字列ではなく、文字列(char)扱いにするのがポイント(電話番号を足したり引いたりみたいに計算はしないので文字列で良い)。
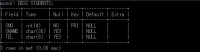
型の設定をしたら各データを「INSERT INTO」文で入力していく。
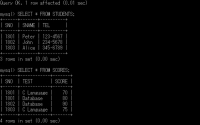
まず、番号1801、名前ピーター、電話番号123-4567から。
mysql> INSERT INTO KADAI01.STUDENTS(SNO, SNAME, TEL) VALUES ('1801', 'Peter', '123-4567');
Query OK, 1 row affected (0.04 sec)
こんな感じで、ジョンとアリスも入れていく。
mysql> INSERT INTO KADAI01.STUDENTS(SNO, SNAME, TEL) VALUES ('1802', 'John', '234-5678');
Query OK, 1 row affected (0.03 sec)
mysql> INSERT INTO KADAI01.STUDENTS(SNO, SNAME, TEL) VALUES ('1803', 'Alice', '345-6789');
Query OK, 1 row affected (0.06 sec)
(b)SCORES(成績)表の定義のために入力したSQL文
学籍番号とテスト名の複合キーを作らなければいけない。
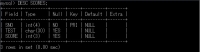
設定変更①取り消し
「ALTER TABLE テーブル名 DROP 変更箇所」で取り消せる。
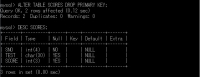
設定変更②設定追加
「ALTER TABLE テーブル名 ADD 追加箇所」で追加できる。
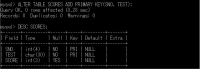
これで学籍番号とテスト名の復号キーができた。
SCORES(成績)表のデータも入れていく。
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1801', 'C Language', '70');
Query OK, 1 row affected (0.06 sec)
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1801', 'Database','80');
Query OK, 1 row affected (0.08 sec)
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1802', 'Database','90');
Query OK, 1 row affected (0.04 sec)
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1803', 'C Language', '75');
Query OK, 1 row affected (0.01 sec)
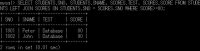
(c)各々の表について設定されたデータの一覧を表示
「SELECT * FROM」文で表示ができる。
※ヒントというか条件
STUDENTS(学生)表のSNO列は学生を一意に識別する番号(学生番号)を格納する列であり,この表の主キーである。SNAME列は学生氏名,TEL列は電話番号を格納する列である。
また,SCORES(成績)表のSNO列は学生を一意に識別する番号(学生番号)を,TEST列は試験の名称を,SCORE列は評価点を格納する列である。試験の名称は試験を一意に識別するものとする。この表の主キーはSNO列とTEST列による複合キーである。
なお,STUDENTS表のSNO列とSCORES表のSNO列は同一ドメインの列とし,両者の間に参照制約を設定すること。
表の作成に関して特に指定のない事項(例えば,データ型など)については,各自の判断で適正に対処すること。
問2
上で設定した表を対象に,以下の(a)から(c)の指示に従ってSQL文を実行しなさい。
(a)名前の昇順表示
「ORDER BY SNAME ASC」で名前をアルファベット順に並べ替えてくれる。

(b)平均点の算出
「AVG」で平均を返してくれる。ちなみに二科目テストを受けている人が1801番のピーターしかいないのでかなり盛り上がらない。

(c)条件式と表の結合
SCORES表のすべての成績のうち,評価点(SCORE)が80以上の成績について,学生番号(SNO),学生氏名(SNAME),試験の名称(TEST),評価点(SCORE)を表示しなさい。
①条件式
とりあえずSCORES表の80点以上の成績だけ抽出してみる。
80点以上という条件をつけて絞り込む方法は以下の不等式を作る。

②表の結合
だが、これだと学生氏名が持ってこれてないので、STUDENTS表からピーターとジョンを持ってくる必要がある。
具体的には、どちらの表にもあるプライマリーキーである学籍番号(SNO)を等式で繋いでしまう。

最後にこれを同時に行なってみる。ただ単純にコードをつなぐだけで実行してくれた。ありがとう(´;ω;`)
ちなみにテキストも理論的なものが書いてあるだけで、特定のソフトの使い方などは書いてないので、ほぼノーヒント。テキストはあくまでテキストでマニュアルじゃないのである。(´;ω;`)
つまりコマンドプロンプトとかいじくった経験のある人じゃないと、自分のパソコンぶっ壊しそうでちょっと踏み出せない。てことで、コンピュータに強い後輩に泣きつきました。やっぱり理系はカッチョいい。
逆に、環境設定とかできれば、作成する表自体はかなりシンプルというか・・・エクセルで10分で作れるものだったりする。
結局、大企業の膨大なデータなんかは、今もDBMSで管理しているらしいんだけど、そういう場合もサーバーとかで構築しているみたくて、家庭用パソコンでデータベースを作成とかは現在はほとんどしないし、必要がないんだってよ。
問1
RDBMSをインストールした上で,データベース(名称は任意)を作成しなさい。次に,以下の2つの表を作成し,データも登録しなさい。その際,以下の(a)から(c)を提出しなさい。
名称は任意なので「KADAI01」にしました。
(a)STUDENTS(学生)表の定義のために入力したSQL文
学生番号はユニークな主キーなので、設定でPRI(プライマルキー)とする。
名前と電話番号はデフォルトでNULL(データなし)とするが、学籍番号はしない。
()のなかの数字は桁数。電話番号はハイフンを入れるため、数字列ではなく、文字列(char)扱いにするのがポイント(電話番号を足したり引いたりみたいに計算はしないので文字列で良い)。

型の設定をしたら各データを「INSERT INTO」文で入力していく。
まず、番号1801、名前ピーター、電話番号123-4567から。
mysql> INSERT INTO KADAI01.STUDENTS(SNO, SNAME, TEL) VALUES ('1801', 'Peter', '123-4567');
Query OK, 1 row affected (0.04 sec)
こんな感じで、ジョンとアリスも入れていく。
mysql> INSERT INTO KADAI01.STUDENTS(SNO, SNAME, TEL) VALUES ('1802', 'John', '234-5678');
Query OK, 1 row affected (0.03 sec)
mysql> INSERT INTO KADAI01.STUDENTS(SNO, SNAME, TEL) VALUES ('1803', 'Alice', '345-6789');
Query OK, 1 row affected (0.06 sec)
(b)SCORES(成績)表の定義のために入力したSQL文
学籍番号とテスト名の複合キーを作らなければいけない。

設定変更①取り消し
「ALTER TABLE テーブル名 DROP 変更箇所」で取り消せる。

設定変更②設定追加
「ALTER TABLE テーブル名 ADD 追加箇所」で追加できる。

これで学籍番号とテスト名の復号キーができた。
SCORES(成績)表のデータも入れていく。
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1801', 'C Language', '70');
Query OK, 1 row affected (0.06 sec)
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1801', 'Database','80');
Query OK, 1 row affected (0.08 sec)
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1802', 'Database','90');
Query OK, 1 row affected (0.04 sec)
mysql> INSERT INTO KADAI01.SCORES(SNO, TEST, SCORE) VALUES ('1803', 'C Language', '75');
Query OK, 1 row affected (0.01 sec)
(c)各々の表について設定されたデータの一覧を表示
「SELECT * FROM」文で表示ができる。

※ヒントというか条件
STUDENTS(学生)表のSNO列は学生を一意に識別する番号(学生番号)を格納する列であり,この表の主キーである。SNAME列は学生氏名,TEL列は電話番号を格納する列である。
また,SCORES(成績)表のSNO列は学生を一意に識別する番号(学生番号)を,TEST列は試験の名称を,SCORE列は評価点を格納する列である。試験の名称は試験を一意に識別するものとする。この表の主キーはSNO列とTEST列による複合キーである。
なお,STUDENTS表のSNO列とSCORES表のSNO列は同一ドメインの列とし,両者の間に参照制約を設定すること。
表の作成に関して特に指定のない事項(例えば,データ型など)については,各自の判断で適正に対処すること。
問2
上で設定した表を対象に,以下の(a)から(c)の指示に従ってSQL文を実行しなさい。
(a)名前の昇順表示
「ORDER BY SNAME ASC」で名前をアルファベット順に並べ替えてくれる。

(b)平均点の算出
「AVG」で平均を返してくれる。ちなみに二科目テストを受けている人が1801番のピーターしかいないのでかなり盛り上がらない。

(c)条件式と表の結合
SCORES表のすべての成績のうち,評価点(SCORE)が80以上の成績について,学生番号(SNO),学生氏名(SNAME),試験の名称(TEST),評価点(SCORE)を表示しなさい。
①条件式
とりあえずSCORES表の80点以上の成績だけ抽出してみる。
80点以上という条件をつけて絞り込む方法は以下の不等式を作る。
②表の結合
だが、これだと学生氏名が持ってこれてないので、STUDENTS表からピーターとジョンを持ってくる必要がある。
具体的には、どちらの表にもあるプライマリーキーである学籍番号(SNO)を等式で繋いでしまう。

最後にこれを同時に行なってみる。ただ単純にコードをつなぐだけで実行してくれた。ありがとう(´;ω;`)

『「主権者教育」を問う』
2018-08-22 13:56:59 (7 years ago)
著者は千葉大学名誉教授の新藤宗幸さん。
2022年度から高校の公民には「現代社会」に代わって「公共」という必修科目ができて、この科目が高校の道徳教育の中核になると捉えられているんですが、その目玉が主権者教育なんだ。
で、今回ちょっと勉強不足だったなって思ったので、改めて文科省のサイトとか読んでみたんだけど、お役所の文章って、まず長いし、しかも読んでてハッキリしろよこのやろー!みたいなストレスもあり、解説本に逃げた次第です。
さて、オルテガの『大衆の反逆』の記事でも書いたんだけど、私は正直、政治的な話題って面白いっちゃ面白いんだけど、けっこうセンシティブというか、あまりに真剣にのめり込んじゃう人が相手だとファナティックでちょっと怖くて、まあ、会話する相手によるよなあってスタンス。
シールズとかも、どっちかというとシンパシーは大して感じないし(著者の進藤さんはシールズを応援しているタイプで、そこは政治的ニヒルな私とはちょっと違うところ)、市民運動的なこともしたことないし。
だから公立学校で一斉に政治参加を呼びかけるって正直どうなんだろうっていうのと、あと、今の政権の動向を踏まえるとさ、お前ら本気で主権者教育なんかやる気ねえだろっていうのが見え見えで、だったら、いっそ安倍さんの100の魅力を高校で教えなさいくらいのことやったほうが面白いんじゃないかなとも思う。
私も12個くらいは安倍さんのいいところ答えられそうだけど、憤りを感じるのはさ、やっぱり森友学園問題なんだよ。
あの籠池さんっていう結構右翼的な教育やってた人いたじゃん。あの人ってすっごい安倍さんのこと好きで、すごい忖度して、お国のために生きなさいみたいな教育を熱心にやってたのにさ、結局安倍さんはかばってくれなかったじゃん。あれは超かわいそうだなあって。
だから、高校の先生がさ、一生懸命政府の意向に沿って右翼教育やってもさ、いきすぎて世論に叩かれたら、絶対政府はかばってくれないぞっていう悲しいジレンマがあるよ。お前が勝手にやったことだろ、みたいな。
安倍さんや自民党のイデオロギーは置いといてさ、もしあそこでさ、安倍さんが国会で、「籠池さんは私の友人です。誰がなんと言おうとも私は彼の味方です!」って言ってくれたらさ、イデオロギーは置いといて、私は安倍さんがかなり好きになったんだけど、あれはガッカリしたよ。
まあ、とどのつまりさ、権力者におもねるような思考停止人間を増やそうとしている気はするんだけど、あまり露骨にやっちゃうと、さすがに愚鈍な国民にもバレちゃうから、一応こういう企画でもやっとくか~ってのが本音なんだろうなっていうのが、この本を読むとよくわかります。著者が主権者教育にかぎかっこをつけた意図は本当によくわかる。
以下は、勉強になったり、同感だなって思うところね。
・選挙権年齢の18歳への引き下げは、他の先進国に習ったというのもあるが、日本国憲法の改正手続における国民投票の投票権年齢が18歳からだったので、これに合わせたという事情もある。(3ページ)
・主権者教育の大きな目標は文科省と総務省による『副読本』によれば
①政治に参加する意義や政治が自らに与える影響などを生徒に理解させること。
②違法な選挙運動をおこなうことがないように選挙制度を理解させること。(5ページ)
・ところが、(略)「主権者教育」と表裏一体で強調されているのは、「教育における政治的中立性」だ。自民党議員の一部からは、「教育における政治的中立性」を逸脱した学習指導をおこなう教員には刑事罰を科すべきとの声が、臆面もなく発せられている。(5ページ)
・「主権者教育」のための教員用『指導資料』は、「一つの結論を出すよりも結論に至るまでの冷静で理性的な議論の過程が重要であることを生徒に理解させることが重要である」と、くりかえしている。だが、二〇一五年通常国会での安全保障法制の審議において憲法上の疑義を問われた安倍晋三首相は、「わたしは首相なのです」と自らの憲法解釈を「絶対視」する発言をかさねた。また政権に都合の悪いことを発言しかねない内閣法制局長官を更迭し、自らの意に沿って忠勤を励むであろう人物を長官に任命した。最高権力者のどこに「冷静で理性的」な議論への態度を見出すことができるのか。(9ページ)
・「不思議」なことに『副読本』には、現代民主制の基本である権力と自由についての記述がまったく見られない。『指導資料』においても、まったく触れられていない。選挙権をもち選挙を通じて法律・予算などの規範をつくり、国家・社会の秩序を維持することが「政治」であるというならば、共産党一党支配の社会主義国はもとより戦前期日本にもあてはまる。(12ページ)
・『副読本』も『指導資料』も政治的教養のゆたかな若者を育てるという。そうであるならば、「国家・社会の形成者」を強調するのではなく、現代民主制において個人は法によって自由を保障されているのであり、権力が個人を抑圧する法律・予算をつくるならば、個人はそれに抵抗する権利を留保していることを教えなくてはなるまい。(14ページ)
・ところが『指導資料』は、「特定の事項を強調しすぎたり、一面的な見解を十分な配慮なく取り上げたりするなど、特定の見方や考え方に偏った取り扱いにより、生徒が主体的に考え、判断することを妨げることのないように留保することが求められる」と、教師に注文を付ける。いったい「偏った取り扱い」とはなにを意味するのだろうか。(20ページ)
・「憲法を守れ」という市民の運動を抑制することは、思想・良心の自由や言論・集会の自由についての抑圧である。「政治的中立」を理由とした市民の活動への介入こそが、まさに「政治的」といわねばならない。(23ページ)
・政治から離れるということによって、教育の政治的中立性が得られるかのように見える(略)現実にはこういう法律が成立することによって、教育者が政治問題に触れることを恐れて、結局教育の中に正しい政治的判断する力が養われないような、そういう無気力な教育になってしまう虞れがある。教育公務員というものは一般公務員と違って政治的な問題について十分な関心を持ち、政治的な問題というものを取り上げる責務がある、これが民主主義の要求である。(27ページ※憲法学者鵜飼信成氏の国会答弁)
・第4章の文科省の答申を読む限り、高校生の政治活動はほとんど自由にできないことがわかる。ポーズなだけだという。
・ところで、「Q&A」は、届出制の導入にあたって届出をした生徒の政治信条を問わないなどの配慮を求めているが、このくらい「つまらぬ」条件付けもないだろう。(53ページ)
・政府見解が教科書に記載されることを否定する必要はない。だが、政府見解と異なる意見の存在や説明がしめされないのならば、政治についての見方は平板となり、思考力を養うことはできない。同じ文科省発行の「主権者教育」の『副読本』が、「中立・公正」に複数の意見を説明せよといっているのと、どこで整合するのか。結局のところ、「中立・公正」な記述や説明とは、政府見解を踏襲することになってしまうだろう。(69~70ページ)
2022年度から高校の公民には「現代社会」に代わって「公共」という必修科目ができて、この科目が高校の道徳教育の中核になると捉えられているんですが、その目玉が主権者教育なんだ。
で、今回ちょっと勉強不足だったなって思ったので、改めて文科省のサイトとか読んでみたんだけど、お役所の文章って、まず長いし、しかも読んでてハッキリしろよこのやろー!みたいなストレスもあり、解説本に逃げた次第です。
さて、オルテガの『大衆の反逆』の記事でも書いたんだけど、私は正直、政治的な話題って面白いっちゃ面白いんだけど、けっこうセンシティブというか、あまりに真剣にのめり込んじゃう人が相手だとファナティックでちょっと怖くて、まあ、会話する相手によるよなあってスタンス。
シールズとかも、どっちかというとシンパシーは大して感じないし(著者の進藤さんはシールズを応援しているタイプで、そこは政治的ニヒルな私とはちょっと違うところ)、市民運動的なこともしたことないし。
だから公立学校で一斉に政治参加を呼びかけるって正直どうなんだろうっていうのと、あと、今の政権の動向を踏まえるとさ、お前ら本気で主権者教育なんかやる気ねえだろっていうのが見え見えで、だったら、いっそ安倍さんの100の魅力を高校で教えなさいくらいのことやったほうが面白いんじゃないかなとも思う。
私も12個くらいは安倍さんのいいところ答えられそうだけど、憤りを感じるのはさ、やっぱり森友学園問題なんだよ。
あの籠池さんっていう結構右翼的な教育やってた人いたじゃん。あの人ってすっごい安倍さんのこと好きで、すごい忖度して、お国のために生きなさいみたいな教育を熱心にやってたのにさ、結局安倍さんはかばってくれなかったじゃん。あれは超かわいそうだなあって。
だから、高校の先生がさ、一生懸命政府の意向に沿って右翼教育やってもさ、いきすぎて世論に叩かれたら、絶対政府はかばってくれないぞっていう悲しいジレンマがあるよ。お前が勝手にやったことだろ、みたいな。
安倍さんや自民党のイデオロギーは置いといてさ、もしあそこでさ、安倍さんが国会で、「籠池さんは私の友人です。誰がなんと言おうとも私は彼の味方です!」って言ってくれたらさ、イデオロギーは置いといて、私は安倍さんがかなり好きになったんだけど、あれはガッカリしたよ。
まあ、とどのつまりさ、権力者におもねるような思考停止人間を増やそうとしている気はするんだけど、あまり露骨にやっちゃうと、さすがに愚鈍な国民にもバレちゃうから、一応こういう企画でもやっとくか~ってのが本音なんだろうなっていうのが、この本を読むとよくわかります。著者が主権者教育にかぎかっこをつけた意図は本当によくわかる。
以下は、勉強になったり、同感だなって思うところね。
・選挙権年齢の18歳への引き下げは、他の先進国に習ったというのもあるが、日本国憲法の改正手続における国民投票の投票権年齢が18歳からだったので、これに合わせたという事情もある。(3ページ)
・主権者教育の大きな目標は文科省と総務省による『副読本』によれば
①政治に参加する意義や政治が自らに与える影響などを生徒に理解させること。
②違法な選挙運動をおこなうことがないように選挙制度を理解させること。(5ページ)
・ところが、(略)「主権者教育」と表裏一体で強調されているのは、「教育における政治的中立性」だ。自民党議員の一部からは、「教育における政治的中立性」を逸脱した学習指導をおこなう教員には刑事罰を科すべきとの声が、臆面もなく発せられている。(5ページ)
・「主権者教育」のための教員用『指導資料』は、「一つの結論を出すよりも結論に至るまでの冷静で理性的な議論の過程が重要であることを生徒に理解させることが重要である」と、くりかえしている。だが、二〇一五年通常国会での安全保障法制の審議において憲法上の疑義を問われた安倍晋三首相は、「わたしは首相なのです」と自らの憲法解釈を「絶対視」する発言をかさねた。また政権に都合の悪いことを発言しかねない内閣法制局長官を更迭し、自らの意に沿って忠勤を励むであろう人物を長官に任命した。最高権力者のどこに「冷静で理性的」な議論への態度を見出すことができるのか。(9ページ)
・「不思議」なことに『副読本』には、現代民主制の基本である権力と自由についての記述がまったく見られない。『指導資料』においても、まったく触れられていない。選挙権をもち選挙を通じて法律・予算などの規範をつくり、国家・社会の秩序を維持することが「政治」であるというならば、共産党一党支配の社会主義国はもとより戦前期日本にもあてはまる。(12ページ)
・『副読本』も『指導資料』も政治的教養のゆたかな若者を育てるという。そうであるならば、「国家・社会の形成者」を強調するのではなく、現代民主制において個人は法によって自由を保障されているのであり、権力が個人を抑圧する法律・予算をつくるならば、個人はそれに抵抗する権利を留保していることを教えなくてはなるまい。(14ページ)
・ところが『指導資料』は、「特定の事項を強調しすぎたり、一面的な見解を十分な配慮なく取り上げたりするなど、特定の見方や考え方に偏った取り扱いにより、生徒が主体的に考え、判断することを妨げることのないように留保することが求められる」と、教師に注文を付ける。いったい「偏った取り扱い」とはなにを意味するのだろうか。(20ページ)
・「憲法を守れ」という市民の運動を抑制することは、思想・良心の自由や言論・集会の自由についての抑圧である。「政治的中立」を理由とした市民の活動への介入こそが、まさに「政治的」といわねばならない。(23ページ)
・政治から離れるということによって、教育の政治的中立性が得られるかのように見える(略)現実にはこういう法律が成立することによって、教育者が政治問題に触れることを恐れて、結局教育の中に正しい政治的判断する力が養われないような、そういう無気力な教育になってしまう虞れがある。教育公務員というものは一般公務員と違って政治的な問題について十分な関心を持ち、政治的な問題というものを取り上げる責務がある、これが民主主義の要求である。(27ページ※憲法学者鵜飼信成氏の国会答弁)
・第4章の文科省の答申を読む限り、高校生の政治活動はほとんど自由にできないことがわかる。ポーズなだけだという。
・ところで、「Q&A」は、届出制の導入にあたって届出をした生徒の政治信条を問わないなどの配慮を求めているが、このくらい「つまらぬ」条件付けもないだろう。(53ページ)
・政府見解が教科書に記載されることを否定する必要はない。だが、政府見解と異なる意見の存在や説明がしめされないのならば、政治についての見方は平板となり、思考力を養うことはできない。同じ文科省発行の「主権者教育」の『副読本』が、「中立・公正」に複数の意見を説明せよといっているのと、どこで整合するのか。結局のところ、「中立・公正」な記述や説明とは、政府見解を踏襲することになってしまうだろう。(69~70ページ)
『僕、はまじ』
2018-08-21 19:01:32 (7 years ago)
-
カテゴリタグ:
- 本
浜崎憲孝さん著。
誰!?って感じだが、あの国民的アニメ『ちびまる子ちゃん』のクラスのひょうきん者「はまじ」によるまさかの自伝。はまじっていつもお爺ちゃんに「のりたか~」って言われるけど、あれはマジの本名らしいw
当時の『ちびまる子ちゃん』ブームにめっちゃ便乗して出したんだろうけど、あの世界の真実について、作者のまるちゃん以外の別の視点から証言が聞ける、ファンにはたまらない一次資料って感じで面白かった。
文章も小学生レベルとかネットのレビューでは書かれていたけど、あんたらははまじの本に純文学を求めているのか、とキートン山田の声でツッコミたいよ。普通に読みやすかったけどなあ。これで文章が下手なら、けっこうビートたけしさんとかもヘタってなるぜ。
さて、こういうエッセイ漫画ってどこまでが実話で、どこからがフィクションかって結構気になるじゃないですか。で、まるちゃんって1974~75年の小学3年生の時期をず~っと巡回してて、というか2期目の復活放送から絶対に365回以上やってる気がするから、どう考えてもサザエさん時空に突入しちゃっているんだけど、今まで私はずっと、作者のまるちゃんは、この年度というか学年にすごい思い入れがあったのかなって思ってたんだよ。小学3年生の頃が一番楽しかったのかなって。
だが、はまじにとってはこの一年がとても暗く辛かったっていう。その原因ははっきりしていて、まるちゃんのクラスの担任に戸川先生っているじゃん。すごい穏やかな中年の先生。
あれが、実際は漫画とは正反対の、鬼の熱血暴力教師で、はまじは戸川先生との戦いで結局登校拒否になっていたというのだから人生わからない(口調がキートン化してます)。つまり、あの漫画やアニメの時期に、はまじが出席しているというのは実はレアな状況だったというわけだ。
特に泳ぎが苦手なはまじを、どんな手段を用いてもプールに沈めようとする戸川との戦いは必見で、まるちゃんの原作のプール開きのエピソードで、怖い体育教師(戸川先生の実像はこの隣のクラスの先生に移したと思われる)にプールに無理やり投げ込まれて、恐怖のあまり郊外に脱走する生徒は、はまじだったっていうことも分かる。
実際の戸川先生は、まず若く、サングラスにジャージという典型的な体育教師スタイルで、さらに運動会などの行事に熱くなるのも定番というか、自分のクラスの子達に絶対勝たせるため、気付け薬としてウィスキーを飲ませていたというのだから、現代では信じられない(^_^;)
昭和にはこういうめちゃくちゃ怖い先生がたくさんいたのだろうかって、本当に自分は先生に恵まれたなあっていうか、現代に生まれてよかった~ってつくづく感じたよな(って私も昭和生まれなんだけど)。まあ、当時でも保護者からクレームが来て1年で異動になったらしいけど当たり前だよな。
今は、モンスターチルドレンとか、モンスターペアレントとか言うけどさ、モンスターティーチャーはどうすりゃいいんだったあるよ。
特に小学三年生なんて、大野くんや杉山君がいくら喧嘩が強くても、絶対に大人の体育教師なんかに勝てないじゃん。権力的にも肉体的にも教師のが圧倒的に強いからさ、こういうバイオレンスティーチャーにクラスの帝王として君臨されちゃったらたまったもんじゃないよね。子どもの人権とか、民主主義なんかない世界だよな。恐ろしや。
私がもしこんな境遇に陥ったら、はまじじゃないけど絶対に学校行かなくなって今頃ニートよ。
でも、はまじは偉くてさ、「今から考えると先生は熱心すぎるだけなのかもしれない。だけどやり方が派手すぎたんだと思う。(93ページ)」と戸川先生に謝ってるんだけど、私なんかは、あの教師のせいでオレの人生は狂ったとかずっとウジウジ言ってると思うよ(^_^;)はまじは釈迦か。
ちなみに、さくらももこ先生のデビュー作は、そういった問題教師を描いた短編エッセイだったりする。なかなか興味深い。
おまけ:ちびまる子ちゃんのキャラクターの真実(はまじ談)
「まるちゃん」
赤い縁のメガネをかけていて、梅干しおばあちゃんのような見た目だったらしい(ひどい)。また、漫画のイメージだとふくよかなのかなって思ってたけど痩せ型で、成績もまあまあ良かったようだ。国語の成績がいいんだよね、まるちゃんは。中学か高校にエッセイ作文を出したら「現代の清少納言」という称号をもらったりしてたからね。
「たまちゃん」
こちらは、『ちびまる子ちゃん』の方でも作者が言及してたけど、小学校の頃はメガネはかけていなかった。確か高校の頃からだったかな。
しかも、見た目もショートカットでボーイッシュな元気のある女子で、姉御肌って感じだったみたい。また、すごい笑い上戸ではまじのギャグにめちゃくちゃ受けてくれたという。ズバリとてもいいオーディエンスですね、ハイ。
「花輪くん」
実は代々病院を経営する家の女子生徒で、金持ちではあったが流石にあんなこち亀の中川的なレベルではなかったという。ちなみに花輪くんという名前は『刑務所の中』などの作者である漫画家の花輪和一からだったと思う。
「丸尾くん」
名前はやっぱり異なるが、実在はしている。「ズバリ~でしょう」とは言わなかったものの、口調はあんな感じで丁寧で、常に学級委員をやっていた。現在はコンピュータの大企業の重鎮として君臨、美人な奥さんもいるらしい。ズバリ勝ち組でしょう!!
「野口さん」
実際のあだなは「のろ」で、そこから野口という名前にしたんだろうと、はまじは推測する。家庭環境が複雑で、暗い影を背負っていたという。
「ブー太郎」
実際のあだ名は「アカベー」見た目はそっくりらしい。実家はスーパーマーケットを経営しており、はまじとはかなり仲良しだったという。
「ナベちゃん(渡辺くん)」
まるちゃんが風邪で欠席した際、給食のプリンをジャンケンでゲットした男として有名な彼だが、実際のあだ名は「ワタ」で、しかも二枚目だったらしい。はまじが好きな女子はワタに恋をしていたりして、親友としてはまじはかなり切ない思いをしたらしい。
「大野君と杉山君」
実在しない。こんな正義感のあるコンビがいたら、暴君戸川学級はどうなってたんだろう、ちょっと想像つかないもんね。喧嘩最強説のある花輪くんも実際は女の子だし。
「はまじ」
漫画やアニメでははまじのお父さんは全く登場しないが、実はこの頃には離婚をしていたという(はまじが高校生の頃死別)。また、はまじのお父さんは世界の海を回る漁師さんで、離婚する前もなかなか会えなかったらしい。ただし、はまじとの仲は別に悪くなかったようだ。
漫画と同様にひょうきんで、一時期は本気でお笑いの道に進もうとして上京、西川のりおさんの弟子になろうと試みるが、のりおさんに「自分はまだ弟子を取れるような身分じゃないで、ゴメンな」と謙虚に断られている。
ちなみに、小学生当時の行きつけの駄菓子屋は「みつや(単行本第一巻の表紙やアニメ第一期のOPなどに登場する駄菓子屋)」ではなく「おきん」派。
誰!?って感じだが、あの国民的アニメ『ちびまる子ちゃん』のクラスのひょうきん者「はまじ」によるまさかの自伝。はまじっていつもお爺ちゃんに「のりたか~」って言われるけど、あれはマジの本名らしいw
当時の『ちびまる子ちゃん』ブームにめっちゃ便乗して出したんだろうけど、あの世界の真実について、作者のまるちゃん以外の別の視点から証言が聞ける、ファンにはたまらない一次資料って感じで面白かった。
文章も小学生レベルとかネットのレビューでは書かれていたけど、あんたらははまじの本に純文学を求めているのか、とキートン山田の声でツッコミたいよ。普通に読みやすかったけどなあ。これで文章が下手なら、けっこうビートたけしさんとかもヘタってなるぜ。
さて、こういうエッセイ漫画ってどこまでが実話で、どこからがフィクションかって結構気になるじゃないですか。で、まるちゃんって1974~75年の小学3年生の時期をず~っと巡回してて、というか2期目の復活放送から絶対に365回以上やってる気がするから、どう考えてもサザエさん時空に突入しちゃっているんだけど、今まで私はずっと、作者のまるちゃんは、この年度というか学年にすごい思い入れがあったのかなって思ってたんだよ。小学3年生の頃が一番楽しかったのかなって。
だが、はまじにとってはこの一年がとても暗く辛かったっていう。その原因ははっきりしていて、まるちゃんのクラスの担任に戸川先生っているじゃん。すごい穏やかな中年の先生。
あれが、実際は漫画とは正反対の、鬼の熱血暴力教師で、はまじは戸川先生との戦いで結局登校拒否になっていたというのだから人生わからない(口調がキートン化してます)。つまり、あの漫画やアニメの時期に、はまじが出席しているというのは実はレアな状況だったというわけだ。
特に泳ぎが苦手なはまじを、どんな手段を用いてもプールに沈めようとする戸川との戦いは必見で、まるちゃんの原作のプール開きのエピソードで、怖い体育教師(戸川先生の実像はこの隣のクラスの先生に移したと思われる)にプールに無理やり投げ込まれて、恐怖のあまり郊外に脱走する生徒は、はまじだったっていうことも分かる。
実際の戸川先生は、まず若く、サングラスにジャージという典型的な体育教師スタイルで、さらに運動会などの行事に熱くなるのも定番というか、自分のクラスの子達に絶対勝たせるため、気付け薬としてウィスキーを飲ませていたというのだから、現代では信じられない(^_^;)
昭和にはこういうめちゃくちゃ怖い先生がたくさんいたのだろうかって、本当に自分は先生に恵まれたなあっていうか、現代に生まれてよかった~ってつくづく感じたよな(って私も昭和生まれなんだけど)。まあ、当時でも保護者からクレームが来て1年で異動になったらしいけど当たり前だよな。
今は、モンスターチルドレンとか、モンスターペアレントとか言うけどさ、モンスターティーチャーはどうすりゃいいんだったあるよ。
特に小学三年生なんて、大野くんや杉山君がいくら喧嘩が強くても、絶対に大人の体育教師なんかに勝てないじゃん。権力的にも肉体的にも教師のが圧倒的に強いからさ、こういうバイオレンスティーチャーにクラスの帝王として君臨されちゃったらたまったもんじゃないよね。子どもの人権とか、民主主義なんかない世界だよな。恐ろしや。
私がもしこんな境遇に陥ったら、はまじじゃないけど絶対に学校行かなくなって今頃ニートよ。
でも、はまじは偉くてさ、「今から考えると先生は熱心すぎるだけなのかもしれない。だけどやり方が派手すぎたんだと思う。(93ページ)」と戸川先生に謝ってるんだけど、私なんかは、あの教師のせいでオレの人生は狂ったとかずっとウジウジ言ってると思うよ(^_^;)はまじは釈迦か。
ちなみに、さくらももこ先生のデビュー作は、そういった問題教師を描いた短編エッセイだったりする。なかなか興味深い。
おまけ:ちびまる子ちゃんのキャラクターの真実(はまじ談)
「まるちゃん」
赤い縁のメガネをかけていて、梅干しおばあちゃんのような見た目だったらしい(ひどい)。また、漫画のイメージだとふくよかなのかなって思ってたけど痩せ型で、成績もまあまあ良かったようだ。国語の成績がいいんだよね、まるちゃんは。中学か高校にエッセイ作文を出したら「現代の清少納言」という称号をもらったりしてたからね。
「たまちゃん」
こちらは、『ちびまる子ちゃん』の方でも作者が言及してたけど、小学校の頃はメガネはかけていなかった。確か高校の頃からだったかな。
しかも、見た目もショートカットでボーイッシュな元気のある女子で、姉御肌って感じだったみたい。また、すごい笑い上戸ではまじのギャグにめちゃくちゃ受けてくれたという。ズバリとてもいいオーディエンスですね、ハイ。
「花輪くん」
実は代々病院を経営する家の女子生徒で、金持ちではあったが流石にあんなこち亀の中川的なレベルではなかったという。ちなみに花輪くんという名前は『刑務所の中』などの作者である漫画家の花輪和一からだったと思う。
「丸尾くん」
名前はやっぱり異なるが、実在はしている。「ズバリ~でしょう」とは言わなかったものの、口調はあんな感じで丁寧で、常に学級委員をやっていた。現在はコンピュータの大企業の重鎮として君臨、美人な奥さんもいるらしい。ズバリ勝ち組でしょう!!
「野口さん」
実際のあだなは「のろ」で、そこから野口という名前にしたんだろうと、はまじは推測する。家庭環境が複雑で、暗い影を背負っていたという。
「ブー太郎」
実際のあだ名は「アカベー」見た目はそっくりらしい。実家はスーパーマーケットを経営しており、はまじとはかなり仲良しだったという。
「ナベちゃん(渡辺くん)」
まるちゃんが風邪で欠席した際、給食のプリンをジャンケンでゲットした男として有名な彼だが、実際のあだ名は「ワタ」で、しかも二枚目だったらしい。はまじが好きな女子はワタに恋をしていたりして、親友としてはまじはかなり切ない思いをしたらしい。
「大野君と杉山君」
実在しない。こんな正義感のあるコンビがいたら、暴君戸川学級はどうなってたんだろう、ちょっと想像つかないもんね。喧嘩最強説のある花輪くんも実際は女の子だし。
「はまじ」
漫画やアニメでははまじのお父さんは全く登場しないが、実はこの頃には離婚をしていたという(はまじが高校生の頃死別)。また、はまじのお父さんは世界の海を回る漁師さんで、離婚する前もなかなか会えなかったらしい。ただし、はまじとの仲は別に悪くなかったようだ。
漫画と同様にひょうきんで、一時期は本気でお笑いの道に進もうとして上京、西川のりおさんの弟子になろうと試みるが、のりおさんに「自分はまだ弟子を取れるような身分じゃないで、ゴメンな」と謙虚に断られている。
ちなみに、小学生当時の行きつけの駄菓子屋は「みつや(単行本第一巻の表紙やアニメ第一期のOPなどに登場する駄菓子屋)」ではなく「おきん」派。
読書と豊かな人間性覚え書き
2018-08-17 15:58:44 (7 years ago)
-
カテゴリタグ:
- 司書
なんか、ブックトークとかの話なんだけどさ、いくらプロモーターが熱心にやっても読まねーやつは読まねーよな。ありがちなのは、ブックトークで全部読んだ気になっちゃうってパターンね。ただの読み聞かせじゃねーかっていう。
これがさ、映画とかだと、町山さんとかの解説動画見たあとに、その映画を観たくなったりするんだけどね。本になるともう少し労力がいるからね。映画みたいにボケーと流し見できないからね。
そういう部分も配慮して、例えば新書縛りとか、絵本縛りとか、なるたけあっさり読める本を取り上げたほうがいいのかもね。これをマルクスの『資本論』とか、ドストエフスキーの長編小説とかでやっちゃうと、仮に内容が良くても絶対読まないよね。
なんというかさ、読書習慣って絶対に早期教育だと思う。自分も物心ついた時から絵本の虫だったしさ。そういう経験を全くしないでレディネス期を経過させちゃうと、けっこう厳しいものがあるよな。
年とると知識欲とかなくなってくるらしいもんね。あれなに?これなに?ってあまり言わなくなるもんな。ニーチェじゃないけど、国家に従順な家畜と化すわけよ。
参考文献:天道佐津子編著『読書と豊かな人間性の育成 改訂版』
ブックトークの概要
直訳すると「本を語る」という意味で、子どもたちに読書に対する興味を持たせるために、アメリカで誕生した活動である。しかし、読み聞かせのように、本をそのまま語るわけではなく、あらかじめテーマを決めて、そのテーマに該当する本を5~10冊選び、それらの本を順次紹介していく。ブックトークは簡単なように見えて、その準備にはかなりの時間と労力を要するが、一度作ったブックトークのシナリオは対象者によって多少修正すれば再利用ができる。
目的
①紹介された本を読みたいという気持ちにさせる
②知らなかった本や、知らなかった分野を紹介する
③本や読書そのものの楽しさを伝える
対象
学校のクラスなど、まとまった集団を対象に行うことが多い。ほかにもブックトークをネット中継すれば不特定多数に発信ができる。
方法
具体的に見ていきましょう。
①テーマを決める
子どもたちの実態を観察して、子どもたちが興味や関心を持っていることを事前に調査する。これを踏まえてブックトークのテーマを決める。しかし授業の延長になるようなテーマは控えたほうが良い。それを行うと、子どもは純粋に本を楽しむのではなく、勉強の一環で学ばされるものとして認識する可能性があるからである。
小学校低学年では「イヌ」「ともだち」「おばけ」といった具体的なもの、小学校高学年以上では「生命」「友情」「挑戦」など抽象的なものが良い。
②テーマ設定の理由を明確化する
指導案のように、実践者の思いや、想定される子どもたちの受け止め方などを文章でまとめる。これにより自分のテーマに対する認識がよりクリアになる。
③テーマに沿った本を選ぶ
テーマに対してのコンセプトがはっきりしてきたら、テーマに沿った本を10冊ほど集める。これがなかなか大変な部分で、読書家ならばいろいろな本がイメージとして浮かんでくるのだが、読書量が少ない人には苦痛である。そういった場合は、グループでブックトークを企画しても良いだろう。
また、読書家の人でも注意すべきなのは、あまり難しい本だけを選ばないことである。ブックトークで興味を持っても、難しい本は途中で脱落してしまう可能性がある。
一冊くらい、上級者向けを入れても良いが、読みやすかったり、面白い絵本などもラインナップの中に加えると、充実したブックトークになる。
チョイスした本はもう一度よく読み直して、それぞれの本のどの箇所をテーマに合わせて取り上げるかを考える。この時付箋をつけると良い。
④紹介する本の順序を決める
紹介する順序を決めて、その順番に従って、タイトルや著者名、出版社名などのデータと、簡単な紹介文を書いてみる。この紹介文はブックトークにおけるシナリオに当たるので、対象者を踏まえてあまり難しくなく、そして興味を抱きやすい内容にする。
注意点は、一冊の本をあまり紹介しすぎない点である。聞いている子どもも、自分が読んだ気になってしまい、読まなくていいじゃんってなるからである。
そのためにも、ハイライトシーンの直前で寸止めすれば、そのあとの続きが気になって、たまらなくなるだろう。この手法は『LOST』などの海外ドラマがうまいと思う。で、だいたい引っ張るわりには大した続きじゃないんだよね。
⑤子どもたちの前で実践する
すべての準備が出来たらいよいよシナリオに沿って実践する。客観的な本の紹介というよりは、演じるといったイメージで行うと良い。一冊ずつ表紙を見せながら、シナリオを語って、話し終えた順にその本を前の机に表紙が見えるように立てていく。
最後にアンコール的に、子どもが選んだ絵本を読み聞かせしてもいいだろう。
ブックトークが終わったら、実際に紹介した本を手に取って試し読みしてもらう。そのとき、子どもたちが紹介した本に群がって行ったらブックトークは大成功であるが、この時、子どもに「どうでしたか、読みたい本は決まりましたか?」などと感想や催促をしないことである。
肝心な場面でこれをやられると冷えるからな・・・(C)ハンチョウ
⑥アフターフォロー
ブックトーク後に子どもたちがその本を読みたいと思っても全員分本が行き渡らないことがある。その時に「あとで図書館で借りてください」とか「Aさんの次にしてね」などと言ってしまうと、子どももさすがに興を削がれてしまう。
そうならないためにも、ブックトークのあとに子どもたちがすぐ紹介された本を手に取れるように、ブックトークの会場を図書館にするとか、ブックトークで紹介した本を何冊か教室の学級文庫として持ってくるなど、可能な限りの工夫をする。
また、誰がどの本を読んだかのチェックや、読んだ感想を聞くなどは、くれぐれもしない。
肝心な場面でこれをやられると冷えるからな・・・(C)ハンチョウ
ちなみに子どもたち自身でブックトークをやらせても結構面白い。子どもたちの、読む力、書く力、話す力、企画力、情報活用能力など、まさに主体的で対話的な深い学びが実践できる。
朝の読書の概要
児童生徒の読書を習慣づける目的で、授業が始まる前の朝の学活前後に、10分ほどの読書の時間を設ける活動である。
全員に「読ませる」わけなので、形の上では、ゆるやかな指導とはいえないが、児童生徒に受け入れられたため、平成になって比較的短期間で全国にひろがり、現在ではなんと90%もの小中学校が朝の読書を導入している(2007年のベネッセの調査によれば小学校では94.3%、中学校では86.6%の学校で実施している)。
朝の読書は、もともとは88年に船橋学園女子高校(現在は東葉高校)の社会科教師だった林先生の提唱によってはじまり、同校では今なお以下のような原則が守られている。
①毎朝10分間、黙読する。
②読む本は、生徒が自由に選ぶ。ただしマンガ、雑誌を除く。
③読後に課題が設定されない。ただ、読むだけである。
④教師も読む。その時間、読書に関して指導的役割を果たすことはしない。
朝の読書の最大の功績は、学校の中に評価の対象にならない活動を導入したことだと言われている(何を、どう、何のために読むか、が問われない)。
朝の読書の実施には、生徒の「読まない自由(=本なんか読みたくない)」をどうするかという問題がある。しかし、仮に読書が嫌いな生徒がいても、朝の読書での大多数の集団が作る図書館的な静けさに助けられて、ともかく本に向かうことができるとされている(同調圧力に弱い悲しい日本人)。
つまり、朝の読書には、一日の学校生活が静かな落ち着きの中でスタートできるという生活指導上のメリットもあるのである。
具体的な実践例
朝の読書のパイオニアである東葉高校では、学校図書館の学校司書や司書教諭と、朝の読書の推進委員の先生が協力して、各クラスの学級図書を、学年のレベルを考慮して70~80冊をひとセットにして選出し、分置している。これは図書館から、クラスに貸し出しする形をとっている。
つまり学級図書は、学校図書館がクラスに実物で提示する推薦図書リストであり読書案内であるといえる。
また、読後の課題はないが、せっかくの読書歴を残せるように、生徒全員に配布される原稿用紙の冊子巻末には読書の記録欄がある(もちろん評価対象にはならない)。
こういった学校の図書館活動では、子どもたちが自主的・主体的に参加し、成就感を持つような指導の工夫が不可欠であるため、司書教諭は、学校の教諭だけではなく、保護者や地域のボランティアとの十分な協力態勢を整えるためにコーディネーターとして活躍するべきである。
例えば、ある小学校では、隔週の水曜日に低学年を対象に、保護者による朝の読み聞かせを行っており、これを全校に広げるために司書教諭が中心となってボランティアを募集したという。
こういった活動は、他の学校でも全国的に実施しており、興味深い例では、校長先生がボランティアと共に読み聞かせを行っている小学校や、月に一度、事務職員も含めた全職員で朝の読書を行っている小学校もあるという。
いずれにせよ、まずは大人が率先して本を読む習慣を子どもに見せることが、朝の読書活動においては重要なのではないだろうか。
これがさ、映画とかだと、町山さんとかの解説動画見たあとに、その映画を観たくなったりするんだけどね。本になるともう少し労力がいるからね。映画みたいにボケーと流し見できないからね。
そういう部分も配慮して、例えば新書縛りとか、絵本縛りとか、なるたけあっさり読める本を取り上げたほうがいいのかもね。これをマルクスの『資本論』とか、ドストエフスキーの長編小説とかでやっちゃうと、仮に内容が良くても絶対読まないよね。
なんというかさ、読書習慣って絶対に早期教育だと思う。自分も物心ついた時から絵本の虫だったしさ。そういう経験を全くしないでレディネス期を経過させちゃうと、けっこう厳しいものがあるよな。
年とると知識欲とかなくなってくるらしいもんね。あれなに?これなに?ってあまり言わなくなるもんな。ニーチェじゃないけど、国家に従順な家畜と化すわけよ。
参考文献:天道佐津子編著『読書と豊かな人間性の育成 改訂版』
ブックトークの概要
直訳すると「本を語る」という意味で、子どもたちに読書に対する興味を持たせるために、アメリカで誕生した活動である。しかし、読み聞かせのように、本をそのまま語るわけではなく、あらかじめテーマを決めて、そのテーマに該当する本を5~10冊選び、それらの本を順次紹介していく。ブックトークは簡単なように見えて、その準備にはかなりの時間と労力を要するが、一度作ったブックトークのシナリオは対象者によって多少修正すれば再利用ができる。
目的
①紹介された本を読みたいという気持ちにさせる
②知らなかった本や、知らなかった分野を紹介する
③本や読書そのものの楽しさを伝える
対象
学校のクラスなど、まとまった集団を対象に行うことが多い。ほかにもブックトークをネット中継すれば不特定多数に発信ができる。
方法
具体的に見ていきましょう。
①テーマを決める
子どもたちの実態を観察して、子どもたちが興味や関心を持っていることを事前に調査する。これを踏まえてブックトークのテーマを決める。しかし授業の延長になるようなテーマは控えたほうが良い。それを行うと、子どもは純粋に本を楽しむのではなく、勉強の一環で学ばされるものとして認識する可能性があるからである。
小学校低学年では「イヌ」「ともだち」「おばけ」といった具体的なもの、小学校高学年以上では「生命」「友情」「挑戦」など抽象的なものが良い。
②テーマ設定の理由を明確化する
指導案のように、実践者の思いや、想定される子どもたちの受け止め方などを文章でまとめる。これにより自分のテーマに対する認識がよりクリアになる。
③テーマに沿った本を選ぶ
テーマに対してのコンセプトがはっきりしてきたら、テーマに沿った本を10冊ほど集める。これがなかなか大変な部分で、読書家ならばいろいろな本がイメージとして浮かんでくるのだが、読書量が少ない人には苦痛である。そういった場合は、グループでブックトークを企画しても良いだろう。
また、読書家の人でも注意すべきなのは、あまり難しい本だけを選ばないことである。ブックトークで興味を持っても、難しい本は途中で脱落してしまう可能性がある。
一冊くらい、上級者向けを入れても良いが、読みやすかったり、面白い絵本などもラインナップの中に加えると、充実したブックトークになる。
チョイスした本はもう一度よく読み直して、それぞれの本のどの箇所をテーマに合わせて取り上げるかを考える。この時付箋をつけると良い。
④紹介する本の順序を決める
紹介する順序を決めて、その順番に従って、タイトルや著者名、出版社名などのデータと、簡単な紹介文を書いてみる。この紹介文はブックトークにおけるシナリオに当たるので、対象者を踏まえてあまり難しくなく、そして興味を抱きやすい内容にする。
注意点は、一冊の本をあまり紹介しすぎない点である。聞いている子どもも、自分が読んだ気になってしまい、読まなくていいじゃんってなるからである。
そのためにも、ハイライトシーンの直前で寸止めすれば、そのあとの続きが気になって、たまらなくなるだろう。この手法は『LOST』などの海外ドラマがうまいと思う。で、だいたい引っ張るわりには大した続きじゃないんだよね。
⑤子どもたちの前で実践する
すべての準備が出来たらいよいよシナリオに沿って実践する。客観的な本の紹介というよりは、演じるといったイメージで行うと良い。一冊ずつ表紙を見せながら、シナリオを語って、話し終えた順にその本を前の机に表紙が見えるように立てていく。
最後にアンコール的に、子どもが選んだ絵本を読み聞かせしてもいいだろう。
ブックトークが終わったら、実際に紹介した本を手に取って試し読みしてもらう。そのとき、子どもたちが紹介した本に群がって行ったらブックトークは大成功であるが、この時、子どもに「どうでしたか、読みたい本は決まりましたか?」などと感想や催促をしないことである。
肝心な場面でこれをやられると冷えるからな・・・(C)ハンチョウ
⑥アフターフォロー
ブックトーク後に子どもたちがその本を読みたいと思っても全員分本が行き渡らないことがある。その時に「あとで図書館で借りてください」とか「Aさんの次にしてね」などと言ってしまうと、子どももさすがに興を削がれてしまう。
そうならないためにも、ブックトークのあとに子どもたちがすぐ紹介された本を手に取れるように、ブックトークの会場を図書館にするとか、ブックトークで紹介した本を何冊か教室の学級文庫として持ってくるなど、可能な限りの工夫をする。
また、誰がどの本を読んだかのチェックや、読んだ感想を聞くなどは、くれぐれもしない。
肝心な場面でこれをやられると冷えるからな・・・(C)ハンチョウ
ちなみに子どもたち自身でブックトークをやらせても結構面白い。子どもたちの、読む力、書く力、話す力、企画力、情報活用能力など、まさに主体的で対話的な深い学びが実践できる。
朝の読書の概要
児童生徒の読書を習慣づける目的で、授業が始まる前の朝の学活前後に、10分ほどの読書の時間を設ける活動である。
全員に「読ませる」わけなので、形の上では、ゆるやかな指導とはいえないが、児童生徒に受け入れられたため、平成になって比較的短期間で全国にひろがり、現在ではなんと90%もの小中学校が朝の読書を導入している(2007年のベネッセの調査によれば小学校では94.3%、中学校では86.6%の学校で実施している)。
朝の読書は、もともとは88年に船橋学園女子高校(現在は東葉高校)の社会科教師だった林先生の提唱によってはじまり、同校では今なお以下のような原則が守られている。
①毎朝10分間、黙読する。
②読む本は、生徒が自由に選ぶ。ただしマンガ、雑誌を除く。
③読後に課題が設定されない。ただ、読むだけである。
④教師も読む。その時間、読書に関して指導的役割を果たすことはしない。
朝の読書の最大の功績は、学校の中に評価の対象にならない活動を導入したことだと言われている(何を、どう、何のために読むか、が問われない)。
朝の読書の実施には、生徒の「読まない自由(=本なんか読みたくない)」をどうするかという問題がある。しかし、仮に読書が嫌いな生徒がいても、朝の読書での大多数の集団が作る図書館的な静けさに助けられて、ともかく本に向かうことができるとされている(同調圧力に弱い悲しい日本人)。
つまり、朝の読書には、一日の学校生活が静かな落ち着きの中でスタートできるという生活指導上のメリットもあるのである。
具体的な実践例
朝の読書のパイオニアである東葉高校では、学校図書館の学校司書や司書教諭と、朝の読書の推進委員の先生が協力して、各クラスの学級図書を、学年のレベルを考慮して70~80冊をひとセットにして選出し、分置している。これは図書館から、クラスに貸し出しする形をとっている。
つまり学級図書は、学校図書館がクラスに実物で提示する推薦図書リストであり読書案内であるといえる。
また、読後の課題はないが、せっかくの読書歴を残せるように、生徒全員に配布される原稿用紙の冊子巻末には読書の記録欄がある(もちろん評価対象にはならない)。
こういった学校の図書館活動では、子どもたちが自主的・主体的に参加し、成就感を持つような指導の工夫が不可欠であるため、司書教諭は、学校の教諭だけではなく、保護者や地域のボランティアとの十分な協力態勢を整えるためにコーディネーターとして活躍するべきである。
例えば、ある小学校では、隔週の水曜日に低学年を対象に、保護者による朝の読み聞かせを行っており、これを全校に広げるために司書教諭が中心となってボランティアを募集したという。
こういった活動は、他の学校でも全国的に実施しており、興味深い例では、校長先生がボランティアと共に読み聞かせを行っている小学校や、月に一度、事務職員も含めた全職員で朝の読書を行っている小学校もあるという。
いずれにせよ、まずは大人が率先して本を読む習慣を子どもに見せることが、朝の読書活動においては重要なのではないだろうか。
- Calendar
<< January 2026 >> Sun Mon Tue Wed Thu Fri Sat 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31
- search this site.
- tags
-
- 漫画 (387)
- 脚本 (243)
- 映画 (235)
- 雑記 (163)
- ゲーム (156)
- 本 (116)
- 教育 (107)
- 生物学 (105)
- 科学 (93)
- 社会学 (81)
- 歴史 (72)
- テレビ (71)
- 芸術 (61)
- 政治 (50)
- 数学 (40)
- 進化論 (40)
- 資格試験 (38)
- 情報 (38)
- サイト・ブログ (37)
- 語学 (37)
- 映画論 (36)
- 物理学 (33)
- 哲学 (32)
- 恐竜 (29)
- 育児 (28)
- 文学 (26)
- 化学 (25)
- 論文 (22)
- PIXAR (22)
- 心理学 (18)
- 地学 (16)
- 気象学 (15)
- 地理学 (15)
- 技術 (13)
- 経済学 (12)
- 医学 (11)
- 玩具 (9)
- 司書 (8)
- 法律学 (7)
- 対談 (5)
- スポーツ (4)
- 映画の評価について (1)
- プロフィール (1)
- archives
-
- 202601 (2)
- 202512 (4)
- 202511 (15)
- 202510 (8)
- 202509 (5)
- 202508 (3)
- 202507 (3)
- 202506 (3)
- 202505 (1)
- 202504 (2)
- 202503 (2)
- 202502 (2)
- 202501 (1)
- 202412 (2)
- 202411 (6)
- 202410 (2)
- 202409 (4)
- 202408 (4)
- 202407 (7)
- 202406 (27)
- 202405 (11)
- 202404 (4)
- 202403 (23)
- 202402 (22)
- 202401 (15)
- 202312 (4)
- 202311 (7)
- 202310 (2)
- 202309 (8)
- 202308 (9)
- 202307 (8)
- 202306 (5)
- 202305 (15)
- 202304 (4)
- 202303 (4)
- 202302 (2)
- 202301 (4)
- 202212 (15)
- 202211 (7)
- 202210 (5)
- 202209 (4)
- 202208 (4)
- 202207 (7)
- 202206 (2)
- 202205 (5)
- 202204 (3)
- 202203 (2)
- 202202 (5)
- 202201 (6)
- 202112 (6)
- 202111 (4)
- 202110 (6)
- 202109 (7)
- 202108 (5)
- 202107 (8)
- 202106 (4)
- 202105 (8)
- 202104 (4)
- 202103 (6)
- 202102 (10)
- 202101 (3)
- 202012 (12)
- 202011 (3)
- 202010 (4)
- 202009 (5)
- 202008 (6)
- 202007 (4)
- 202006 (4)
- 202005 (4)
- 202004 (7)
- 202003 (5)
- 202002 (6)
- 202001 (8)
- 201912 (6)
- 201911 (5)
- 201910 (3)
- 201909 (4)
- 201908 (10)
- 201907 (3)
- 201906 (6)
- 201905 (10)
- 201904 (3)
- 201903 (7)
- 201902 (8)
- 201901 (5)
- 201812 (7)
- 201811 (12)
- 201810 (7)
- 201809 (5)
- 201808 (10)
- 201807 (5)
- 201806 (19)
- 201805 (14)
- 201804 (11)
- 201803 (15)
- 201802 (4)
- 201801 (6)
- 201712 (4)
- 201711 (3)
- 201710 (11)
- 201709 (9)
- 201708 (15)
- 201707 (7)
- 201706 (4)
- 201705 (5)
- 201704 (6)
- 201703 (7)
- 201702 (6)
- 201701 (3)
- 201612 (3)
- 201611 (7)
- 201610 (7)
- 201609 (2)
- 201608 (8)
- 201607 (8)
- 201606 (7)
- 201605 (3)
- 201604 (4)
- 201603 (8)
- 201602 (3)
- 201601 (2)
- 201512 (3)
- 201511 (3)
- 201510 (4)
- 201509 (4)
- 201508 (8)
- 201507 (17)
- 201506 (2)
- 201505 (5)
- 201504 (9)
- 201503 (20)
- 201502 (7)
- 201501 (4)
- 201412 (5)
- 201411 (3)
- 201410 (2)
- 201409 (3)
- 201408 (3)
- 201407 (3)
- 201406 (12)
- 201405 (6)
- 201404 (7)
- 201403 (5)
- 201402 (12)
- 201401 (9)
- 201312 (6)
- 201311 (9)
- 201310 (8)
- 201309 (6)
- 201308 (6)
- 201307 (6)
- 201306 (10)
- 201305 (10)
- 201304 (23)
- 201303 (17)
- 201302 (16)
- 201301 (5)
- 201212 (10)
- 201211 (4)
- 201210 (18)
- 201209 (4)
- 201208 (30)
- 201207 (7)
- 201206 (4)
- 201205 (6)
- 201204 (4)
- 201203 (4)
- 201202 (3)
- 201201 (3)
- 201112 (4)
- 201111 (7)
- 201110 (3)
- 201109 (9)
- 201108 (3)
- 201107 (7)
- 201106 (2)
- 201105 (11)
- 201104 (7)
- 201103 (14)
- 201102 (19)
- 201101 (27)
- 201012 (25)
- 201011 (70)
- 201010 (34)
- 201009 (30)
- 201008 (42)
- 201007 (44)
- 201006 (29)
- 201005 (37)
- 201004 (50)
- 201003 (44)
- 201002 (48)
- 201001 (38)
- 200912 (20)
- recent trackback
- others
-
- RSS2.0
- hosted by チカッパ!
- HEAVEN INSITE(本サイト)


1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | 173 | 174 | 175 | 176 | 177 | 178 | 179 | 180 | 181 | 182 | 183 | 184 | 185 | 186 | 187 | 188 | 189 | 190 | 191 | 192 | 193 | 194 | 195 | 196 | 197 | 198 | 199 | 200 | 201 | 202 | 203 | 204 | 205 | 206 | 207 | 208 | 209 | 210 | 211 | 212 | 213 | 214 | 215 | 216 | 217 | 218 | 219 | 220 | 221 | 222 | 223 | 224 | 225 | 226 | 227 | 228 | 229 | 230 | 231 | 232 | 233 | 234 | 235 | 236 | 237 | 238 | 239 | 240 | 241 | 242 | 243 | 244 | 245 | 246 | 247 | 248 | 249 | 250 | 251 | 252 | 253 | 254 | 255 | 256 | 257 | 258 | 259 | 260 | 261 | 262 | 263 | 264 | 265 | 266 | 267 | 268 | 269 | 270 | 271 | 272 | 273 | 274 | 275 | 276 | 277 | 278 | 279 | 280 | 281 | 282 | 283 | 284 | 285 | 286 | 287 | 288 | 289 | 290 | 291 | 292 | 293 | 294 | 295 | 296 | 297 | 298 | 299 | 300 | 301 | 302 | 303 | 304 | 305 | 306 | 307 | 308 | 309 | 310 | 311 | 312 | 313 | 314 | 315 | 316 | 317 | 318 | 319 | 320 | 321 | 322 | 323 | 324 | 325 | 326 | 327 | 328 | 329 | 330 | 331 | 332 | 333 | 334 | 335 | 336 | 337 | 338 | 339 | 340 | 341 | 342 | 343 | 344 | 345 | 346 | 347 | 348 | 349 | 350 | 351 | 352 | 353 | 354 | 355 | 356